生体内微小環境で化学反応・生物応答を制御!!
私たちの研究室では、有機合成化学をベースに、新しいがん治療を目指した創薬研究、ケミカルバイオロジー研究分野における技術革新を目指した研究を展開します。特に、がん細胞の低酸素環境や局所環境下での核反応などの生体内微小環境に着目した研究や、タンパク質表面での局所環境下で選択的に機能するタンパク質分子修飾法の開発等に取り組んでいます。中村研の研究は、金属触媒化学に立脚した新合成方法論開拓をはじめ、創薬科学、ケミカルバイオロジーといった境界領域の研究分野、さらに応用展開型研究として中性子捕捉療法に展開しており,それぞれの研究テーマは共通して有機合成化学によるものづくりから始まっています。
中村・岡田研の研究戦略
生物活性化合物や機能性分子をデザイン、有機合成し、得られた分子は自分たちの研究室で評価することによって、より優れた分子のデザインにフィードバックするといったスタイルで研究を展開しています。望みの化合物を有機合成するだけに留まらず、機能・活性評価の結果を有機化学的な視点によって考察する力を養うことで、有機合成を基盤とした革新的な研究技術・疾患治療戦略につながる研究を展開することを目指しています。
研究室では、向上心さえあれば、分子のデザイン・合成から、評価、新規な活性・機能性分子の創製に至るまでの研究課題を個人で遂行できるような研究・教育環境があります。有機化学と生物学の境界領域で、世界に先駆けた研究を一緒に展開してみませんか。
生物活性物質の新規骨格創出に基づく創薬化学
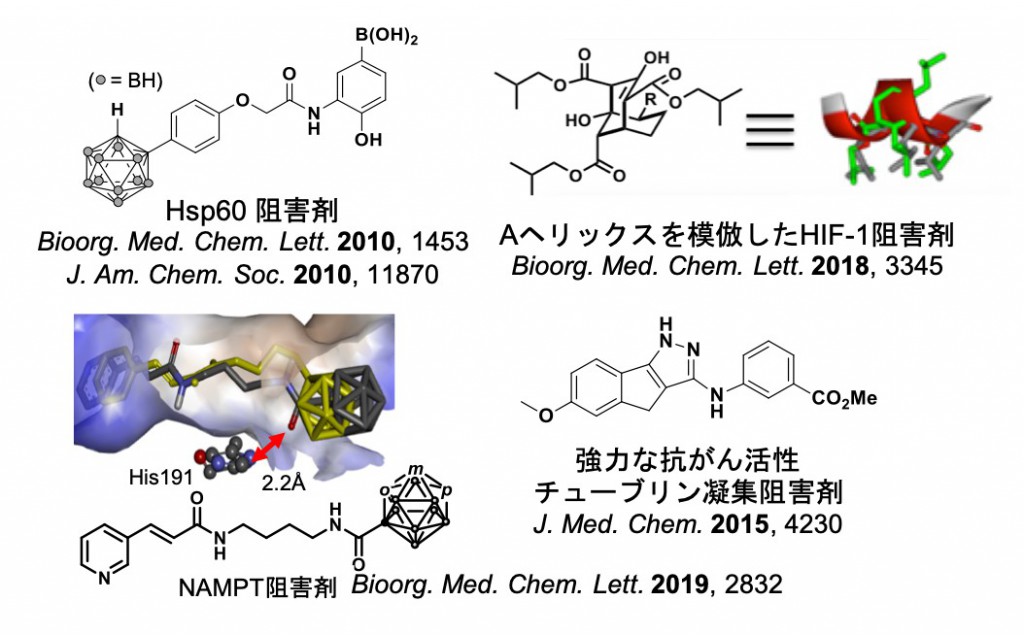
生物活性化合物のコア骨格構造の展開は創薬化学において重要な基盤技術に位置づけられます。私たちは生物活性化合物の骨格構造を新規にデザイン、有機合成化学的に効率的に合成し、自ら活性評価・化合物デザインにフィードバックするというスタイルで研究しています。特に、ホウ素元素の特徴を活かした創薬研究やタンパク質ータンパク質相互作用を標的とした三次元骨格小分子のデザイン、さらにケミカルバイオロジー的な手法により、プローブ分子の開発や合成した化合物の標的の同定にも取り組んでいます。
私たちが開発した生物活性分子
ホウ素中性子捕捉療法のための次世代ホウ素キャリアの開発
ホウ素中性子捕捉療法(Boron Neutron Capture Therapy; BNCT)とは人体には無害の低エネルギー熱中性子をホウ素薬剤により捕捉させ、熱中性子とホウ素10(10B)との反応により、一細胞内の微小環境でリチウムとα線を発生させてがん細胞を破壊する新しいがん治療法です。
低エネルギーの熱中性子はエネルギーの高い高速中性子とは異なり、人体には無害ですが、熱中性子と10Bとの反応は、リチウムとヘリウム原子核(α線)を生じ、これらのエネルギーは2.4MeVとおよそ1つの細胞を破壊するのに十分なエネルギーです(式1)。
血管形成が未熟な腫瘍組織周辺はリポソームなどの微粒子が蓄積しやすいという効果(EPR効果)に基づき、腫瘍組織へのドラッグデリバリーシステムを活用しています。また、BNCTの臨床実用における大きな障害として、高濃度のホウ素薬剤をがん細胞に集積させる技術開発が挙げられます。そこで、私たちは高濃度の10Bをがん細胞に集積させるため、ホウ素含有リポソームやホウ素化アルブミンを開発しています。
これまでに、マウスを用いた腫瘍モデルにおいては優れた治癒効果、延命効果を得ることに成功しています。その他にもアクティブターゲッティング法や、生体高分子のホウ素クラスター修飾に基づいた次世代ホウ素ナノキャリアの開発も行っています。
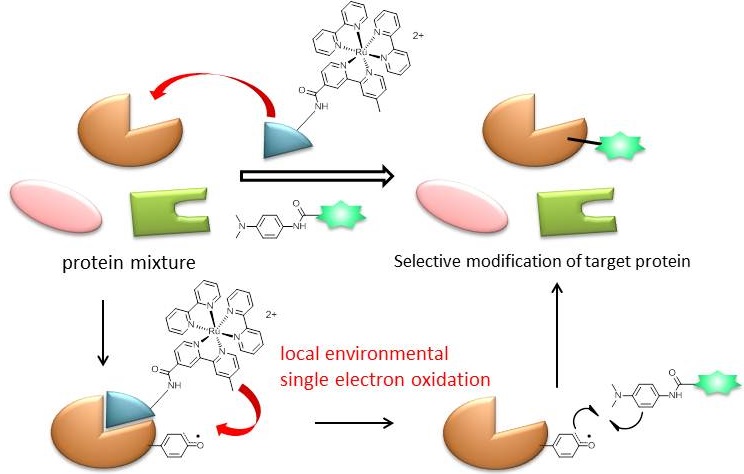
光触媒を用いた標的タンパク質ラベル化法の開発
私たちは短寿命のラジカル種をタンパク質分子修飾に応用する研究を展開しています。局所的な環境下においてラジカル反応を制御することで、タンパク質の混ざりの中から、目的のタンパク質を選択的にラベル化するという反応を開発しています。ケミカルバイオロジー研究分野における技術革新を狙った研究です。
一電子酸化触媒であるRu(bpy)3錯体にタンパク質親和性リガンドを共役させることで、この触媒はタンパク質の混在系においてもリガンドが標的とするタンパク質に選択的に結合し、その周辺でのみラジカル的なラベル化反応が触媒できることを明らかにしました。本研究の独創性の高い点は、タンパク質の混在系の中で任意のタンパク質上のアミノ酸残基にラジカル種を発生させ、制御できるといった点にあります。現在は、本技術によって得られたタンパク質のラジカル応答におけるの興味深い挙動を対象とした研究を開始しています。
生体を観察・操作する磁性薬剤の開発
蛍光イメージングなどの紫外可視光を動作原理とする技術は、分子レベルの特異性を有しますが生体広域への適用には限界があります。一方、生体透過性に優れるMRIなどの磁場応用技術では、分子レベルの解析は未だに困難です。私たちは、解析したいターゲットに応じて磁性や分子認識能が変化する常磁性金属プローブを開発しています。磁性プローブと磁性応用技術を組み合わせることで、従来技術ではトレードオフとなる「分子レベル」と「生体レベル」の解析を同時に達成することを目指します。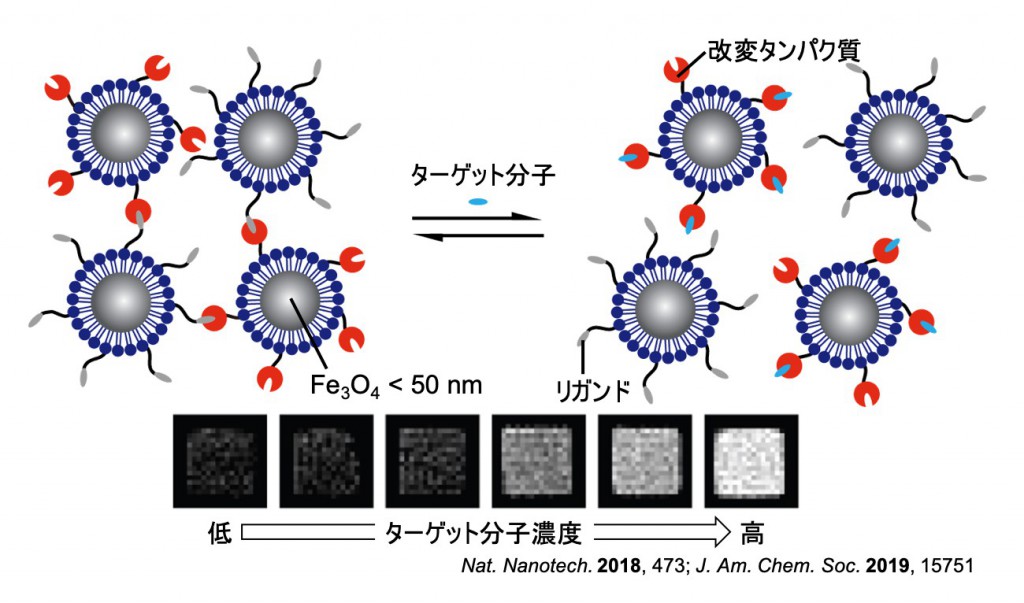 磁性プローブとMRIによる生体分子動態の観察
磁性プローブとMRIによる生体分子動態の観察


 English
English